禁毒百科
Anti Drug Encyclopedia
一、苯基
苯基,指以苯环为官能团的基团,是常见的有机官能团。
体现苯的性质,比如芳香性,能发生亲电反应等。其特征是容易发生亲电取代,难以发生加成反应,而且光谱上这种大共轭体系一般具有特征吸收峰,对于核磁共振,芳香环对于连接其上的氢一般有很强的去屏蔽效应。
中文名:苯基 ;外文名:phenyl group ;分子式:C6H5- ;分子量:77+取代物分子量 ;代表符号:C6H5-、Ph-等; 化学结构:

性质
体现苯的性质,比如芳香性,能发生亲电反应等。其特征是容易发生亲电取代,难以发生加成反应,而且光谱上这种大共轭体系一般具有特征吸收峰,对于核磁共振,芳香环对于连接其上的氢一般有很强的去屏蔽效应。
作为一个官能团,苯基与相连的官能团之间在电性相互作用上,存在诱导效应和共轭效应,要根据所连的官能团具体情况具体分析。对于一般的饱和烷基来说,苯基可以看做吸电子基团 。
用途/用法
作为一个名词,苯基一般出现在化合物命名、描述官能团等场合,它不是一个化合物,是没有实际的“用途”可言的 。
在化学中,这个名词常会有类似的用法:
引入苯基增大共轭体系,
引入苯基使原先不具有紫外信号的化合物转变为有紫外信号的化合物,使之可以被相应仪器检测到,
引入苯基增大局部的位阻,
引入苯基调节电性,等等
这些都是利用苯环的性质来对化合物进行操作。
二、氨基
氨基(Amino)是有机化学中的基本碱基,所有含有氨基的有机物都有一定碱的特性,由一个氮原子和两个氢原子组成,化学式-NH2。如氨基酸就含有氨基,有一定碱的特性。氨基是一个活性大、易被氧化的基团。在有机合成中需要用易于脱去的基团进行保护。简单说几种 :1、酰化保护,即用酸酐保护 2、用苄基保护 3、手性化合物常用CBZ,BOC,FMOC等保护氨基酸,氨基显正电性,是斥电子集团,在氨基酸合成多肽时,氨基能与羧基发生脱水缩合
基本形式:(—NH2)
结构式:
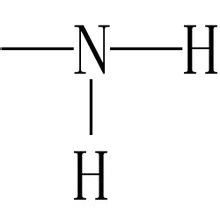
氨基”和“胺基”的区别
严格意义上来说只有氨基并没有胺基。
一般当NH是在该物质的官能团排序是最高的话,就是胺。胺是NH3的氢原子被烃基取代的产物,如甲胺CH3NH2,CH3NH-甲胺基,严格地说是亚氨基,比如苯胺,乙二胺。还有就是特定的官能团名称,比如酰胺。当N的地位不是那么高的话,就是说作为取代基的话,称为氨基,比如甘氨酸,丙氨酸,还有就是如果是以盐的形式存在,称为“铵”。
氨基(Amino)是有机化学中的基本碱基,所有含有氨基的有机物都有一定碱的特性,由一个氮原子和两个氢原子组成,化学式-NH2。如氨基酸就含有氨基,有一定碱的特性。氨基是一个活性大、易被氧化的基团。在有机合成中需要用易于脱去的基团进行保护。
胺基化合物是氨的氢原子被烷基代替后的有机化合物,胺类广泛存在于生物界,具有极重要的生理作用。因此,绝大多数药物都含有胺的官能团——胺基。蛋白质、核酸、许多激素、抗生素和生物碱,都含有胺基,是胺的复杂衍生物。
三、甲基
甲基(methyl group),甲烷分子中去掉一个氢原子后剩下的电中性的一价基团。由碳和氢元素组成。甲基作为一个化学基团(-CH3),它能够结合在DNA上某些特定部位,这个甲基和DNA结合过程叫甲基化,相反,甲基从DNA上脱落的过程就叫做去甲基化。
中文名甲
结构式—CH3 (甲基)(一横表示孤对电子)
甲基英文缩写:Me
基常出现在各种有机化合物中,是最常见的基团.
去甲基化由于甲基是合成蛋氨酸、肉碱、肌酸、磷脂、肾上腺素,核糖核酸(RNA)和脱氧核糖核酸(DNA)等具有主要生理作用的物质所必需的基团(Baker等,1985;Frontien等,1994),以及甲基化反应在神经系统、免疫系统、泌尿系统和心血管系统中所起的作用,人们认为生长期动物和成年动物都需要稳定的甲基供体。一般认为动物体内自身不能合成甲基,需要食物中具有富含甲基物质,它们的分子中具有易反应的甲基,从而参与动物生理功能,这类富含甲基的物质称为“甲基供体”,易参与此反应的甲基(即有效甲基),是与氮原子或硫原子连在一起的甲基,象甜菜碱、蛋氨酸、胆碱等(Vogt,1967)。
转甲基甲基由一个化合物转移到另一化合物上的酶反应:A+B-CH3→A-CH3+B。由于N5、N10-亚甲四氢叶酸的酶促还原作用生成N5-甲基四氢叶酸,由一种钴胺酰胺酶的作用将甲基由N5-甲基四氢叶酸转移到同型半胱氨酸上而生成甲硫氨酸。甲硫氨酸由于ATP的作用变成S-腺苷酰甲硫氨酸,此化合物被用做甲基供体生成各种甲基化合物。作为胆碱氧化形式的甜菜碱等也起甲基供体作用。甲基转移反应不仅与含有甲基的胆碱、肌酸、肾上腺素等物质的生成有关系,而且也与解毒、磷脂的变化、核酸及蛋白质的甲基化也有关系,在生理上也是重要的。已知有数十种对各种化合物具特异的转甲基酶。
甲基化金属汞和二价离子汞等无机汞在生物特别是微生物的作用下会转化成甲基汞和二甲基汞,这种转化称为生物甲基化作用。这种转化的逆过程称为生物反甲基化作用。这两种作用构成了微生物的汞循环。
四、羟基
羟基-OH,又称氢氧基,是一种常见的极性基团。羟基主要有醇羟基,酚羟基等。是由一个氢原子和一个氧原子组成的一价原子团(—OH)。羟基与水有某些相似的性质,羟基是典型的极性基团,与水可形成氢键,在无机化合物水溶液中以带负电荷的离子形式存在(OH-1),称为氢氧根。
中文名羟基,外文名oxhydryl、hydroxyl,别称氢氧基。“羟”是化学家发明的字,以“氢”与“氧”二字各取一部份造出。读音则是“氢”的声母(qīng)加上“氧”的韵母及声调(yǎng)利用反切的方式合成一个字。因为j/q/x后面必须接i或ü,所以拼音作qiǎng。
在无机物中,通常含有氢氧根的物质为碱或其它的碱式盐。含氢氧根的物质溶解于水会电离出氢氧根离子,因此含氢氧根的物质水溶液多体现碱性,但是氢氧根是离子,带负电,与羟基有着本质区别,只有极少数弱碱(共价化合物)自带羟基。
在有机物中,在有机化学的系统命名中,在简单烃基后跟着羟基的称作醇,而糖类多为多羟基醛或酮。羟基直接连在苯环上的称作酚。醇羟基不体现出酸性(阿伦尼乌斯酸碱理论中),酚羟基和羧羟基体现出弱酸性(因而苯酚可与钠反应),酚羟基酸性比碳酸弱,强于碳酸氢根;羧羟基(羧基),比碳酸强。具体命名参见-OH原子团的命名。常见化合物的乙醇(俗名:酒精)为非电解质,不显酸性。乙醇中只有羟基上的氢可以电离,因而与钠反应时1mol乙醇只产生0.5mol氢气。
此原子团在有机化合物中称为羟基,是醇(ROH)、酚(ArOH)等分子中的官能团;在无机化合物水溶液中以带负电荷的离子形式存在(OH- ),称为氢氧根。当羟基与苯环相连形成苯酚时,可使苯环致活,显弱酸性。再进基主要进入其邻位、对位。
性质
化学反应:1.还原性,可被氧化成醛或酮或羧酸。2.弱碱性,酚羟基与氢氧化钠反应生成酚钠。虽然呈偏酸性,但很多含羟基有机物的水溶液酸性比水更弱。如甲醇(CH3OH)、乙醇(CH3CH2OH)等。3.可发生消去反应,如乙醇脱水生成乙烯。4.可发生置换反应,醇羟基与金属钠反应置换了羟基中的氢原子,生成了氢气。5.可发生取代反应,分子间脱水成醚(R-O-R”)R与R“为烃基。
区别在很多情况下,由于在示性式中,羟基和氢氧根的写法相同,因此很容易和氢氧根混淆。区别:1、电子数不同:氢氧根为十电子,羟基为九电子;2、二者电子式不同:氢氧根的氧原子有8个电子包围,羟基的氧原子外有7个电子包围。虽然氢氧根和羟基均为原子团,但羟基为官能团,而氢氧根为离子。而且含氢氧根的物质在水溶液中呈碱性,而含羟基的物质的水溶液则多呈偏酸性。氢氧根和羟基在有机化学上的共性是亲核性。
合成保护羟基是有机化学中最常见的官能团之一,无论是醇羟基还是酚羟基均容易被多种氧化剂所氧化。因此在多官能团化合物的合成过程中,羟基或者部分羟基需要先被保护,阻止它参与反应,在适当的步骤中再被转化。
五、羧基
羧基(carboxyl)[suō jī]是有机化学中的基本化学基,所有的含有羧基的有机酸物质都可以叫羧酸,由一个碳原子、两个氧原子和一个氢原子组成,化学式-COOH。如醋酸(CH3-COOH)、氨基酸都含有羧基,这些羧基与烃基直接连接的化合物,叫作羧酸。
羧基官能团简单的说,羧基是由CHO构成的化合物。确切地说 是一个氢原子共享2个氧原子,因为C与2个氧原子之间形成大Π键,故2个O对H的作用是等价的。由羰基和羟基组成的一价原子团,叫做羧基。羧基的性质并非羰基和羟基的简单加和。例如,羧基中的羰基在羟基的影响下变得很不活泼,不跟HCN、NaHSO3等亲核试剂发生加成反应,而它的羟基比醇羟基容易解离,显示弱酸性。在羧酸盐的阴离子中,由于电子的离域作用,发生键的平均化。因此它的两个碳氧键实际上是完全相等的。另外,羧基不能被还原成醛基,要还原羧基必定是用很强的还原剂(LiAlH4),生成的醛会立即被还原。此外由于羧基的特殊结构,使它还具有一定醛基(-CHO)的性质。用新制氢氧化铜辨别醛基与羧基 .现象:羧酸中蓝色絮状沉淀消失,变成蓝色溶液,加热不变化。反应原理是:酸碱中和羧基会与羟基发生酯化反应—COOH+—OH = H2O+—COO—检验试剂:饱和碳酸氢钠溶液。注意 :羧基和酯基中的碳氧双键一般不能发生加成反应,除非与强还原剂(LiAlH4等)反应 [1] 。官能团结构:

羧基
体例结构

人体氨基酸通式如醋酸(CH3COOH)、柠檬酸都含有羧基,都叫羧酸。羧酸是带有官能团羧基(-COOH)的有机化合物。最简单的羧酸是甲酸。可以用新制醋酸化铜检验羧基的存在.现象:蓝色絮状沉淀消失,变成蓝色溶液。反应原理是:氢氧化铜里的氢氧根被羧基氧化,使不可溶的氢氧化铜变成可溶的铜溶液。
检验方法:可以用新制醋酸或氢氧化亚铜检验羧基的存在.现象:蓝色絮状沉淀消失,变成无色溶液即可。HOOC--即是--COOH即羧基,--OH是羟基羧基的检验方法,即为检验酸的通性的方法(如使石蕊变红等),检验羧基还可以用与醇类酯化的方法,但现象不一定很明显。验证有机物中是否含有羧基一般只需 加乙醇和浓硫酸,加热。现象:会产生有香味的油状物时即可。但最保险的方法还是用核磁共振。
六、羰基
羰基(carbonyl group)是由碳和氧两种原子通过双键连接而成的有机官能团(-C=O-)。是醛,酮,羧酸,羧酸衍生物等官能团的组成部分。
中文名:羰基 外文名:carbonyl group 拼 音:tāng jī
有机化学中,羰基化合物指的是一类含有羰基的化合物。
由一个 sp2或sp杂化(见杂化轨道)的碳原子与一个氧原子通过双键(见化学键)相结合而成的基团,可以表示为:羰基C=O的双键的键长约1.22埃。
由于氧的电负性(3.5)大于碳的电负性(2.5),C=O键的电子云分布偏向于氧原子:这个特点决定了羰基的极性和化学反应性。
构成羰基的碳原子的另外两个键,可以单键或双键的形式与其他原子或基团相结合而成为种类繁多的羰基化合物。羰基化合物可分为醛酮类和羧酸类两类(R为烷基):
醛酮类:R─CH=O 醛
R─CO─R 酮
羧酸类:R─CO─OH 羧酸
R─CO─OR′ 羧酸酯
R─CO─O─CO─R′ 酸酐
R─CO─O─O─CO─R′ 酰基过氧化物
R─CO─NH2 酰胺
R─CO─X(X─F、Cl、Br、I) 酰卤
R─CH=C=O 烯酮
R─N=C=O 异氰酸酯
由于碳原子和氧原子的电负性差别,羰基化合物容易与亲核试剂发生亲核加成反应。
羰基的性质很活泼,容易起加成反应,如与氢生成醇。
簇合物中的键结模式
在羰基簇合物化学中,羰基配体有许多不同的键结模式 。大部份常见的羰基配体都是端接配体,但羰基也常连接2个或3个金属原子,形成μ2或μ3的桥接配体)。有时羰基中的碳和氧原子都会参与键结,例如μ3-η就是一个哈普托数为2,连接3个金属原子的桥接配体。
金属中心原子形成反馈π键使M-C键能增强,同时活化了-C-O键。
性质
物理性质:具有强红外吸收。
化学性质:由于氧的强吸电子性,碳原子上易发生亲核加成反应。其它常见化学反应包括:亲核还原反应,羟醛缩合反应。
特征
在进行金属羰基配合物的分析时,常会使用红外吸收光谱法。
羰基化合物
结构和命名
羰基化合物的结构:
在醛(Aldehydes)和酮(Ketones)分子中,都含有一个共同的官能团-羰基,故统称为羰基化合物。醛分子中,羰基至少要与一个氢原子直接相连,故醛基一定位于链端。
羰基化合物的命名:
(1)普通命名法
醛按氧化后生成的羧酸命名,酮看作是甲酮的衍生物。
可用α、β、γ、δ等标记取代基位置。
(2)系统命名法
当分子中含有多种官能团时,首先要确定一个主官能团,然后,选含有主官能团及尽可能含较多官能团的最长碳链为主链。主链编号的原则是要让主官能团的位次尽可能小。命名时,根据主官能团确定母体的名称,其它官能团作为取代基用词头表示,分子中如涉及立体结构要在名称最前面表明其构型,然后根据名称的基本格式写出名称。
羰基化合物的物理性质
(1)沸点:羰基具有偶极矩,增加了分子间的吸引力,沸点比相应相对分子质量的烷烃高,但比醇低。
(2)水溶性:醛酮的氧原子可以与水形成氢键,因此低级醛酮能与水混溶。
羰基化合物的化学性质
1 亲核加成反应
(1)反应机理
反应过程中,一般是亲核试剂中带负电荷的部分(即亲核部分)先进攻底物中不饱和化学键带部分正电荷一端原子,并与之成键,π键断开形成另一端原子的负离子中间体,然后试剂中的亲电部分与负离子中间体结合,形成亲核加成产物。
最有代表性的反应是醛或酮的羰基与格氏试剂加成的反应:RC=O + R'MgCl → RR'C-OMgCl,再水解得醇,这是合成醇的良好办法。在羰基中,O稍显电负性;在格氏试剂中,C-Mg相连,Mg稍显电正性,C是亲核部位。于是格式试剂的亲核碳进攻亲电的羰基碳,双键打开,新的C-C键形成。
羰基可与碳为中心原子的亲核试剂加成,如格氏试剂、HCN、炔化钠。
羰基还可与氮为中心原子的亲核试剂的加成,如氨及其衍生物。
羰基还与氧为中心原子的亲核试剂的加成,如H2O、ROH等。
(2)反应应用——增长碳链
利用亲核加成反应增长碳链
格氏试剂是含卤化镁的有机金属化合物,是一类亲核试剂,在有机合成中应用十分广泛。
格氏试剂可以合成氘代烃;格氏试剂与醛、酮、酯、环氧烷发生亲核加成反应成相应的醇;反应若生成二级醇,还可以氧化成酮,再继续与格氏试剂反应生成三级醇。格氏试剂与二氧化碳作用可制备多一个碳的羧酸。
2 α-活泼氢引起的反应
α-活泼氢引起的反应
与官能团直接相连的碳叫α-碳,而α-碳上的氢即α-氢。α-氢的活性受与之直接相连的官能团或取代基的影响,通常会表现出特殊的反应活性,及比其他的氢的活性大,比较容易发生化学反应的特性和反应。
含有α-H的醛的存在下,在稀碱的存在下,可以互相结合生成β-羟醛基,受热后进而生成α、β-不饱和醛(有第二个α-H),通过羟醛缩合,在分子中形成了新的碳碳键,增长了碳链。
酮式、烯醇式的互变异构、醛酮的α-H卤代、卤仿反应、羟醛缩合反应等。 [1]
3 氧化和还原反应
(1)氧化反应
醛极易氧化,许多氧化剂都能将醛氧化成酸。脂肪醛比芳醛容易氧化。然而,将醛暴露在空气中,则是芳醛比脂肪醛容易氧化,这是因为用化学氧化剂氧化为离子型氧化反应。
酮遇一般氧化剂,抗拒氧化。酮遇强烈氧化剂,碳链断裂,形成酸。酮氧化时碳碳键断裂,一般地生成混合物,意义不大,但是环酮氧化后可得单一化合物,在制备上有意义。
酮能发生一个特殊的氧化反应:拜耳-魏立格(Baeyer-Villiger)氧化,即酮类化合物被过酸氧化,与羰基直接相连的碳链断裂,插入一个氧形成酯的反应。 [1]
(2)还原反应
醛或酮还原成醇
醛和酮在一定条件下经催化氧化可还原成醇,但需要注意:有些反应需要在加温、加压或有特殊催化剂才能进行;最常用的溶剂是醇;如羰基两侧的立体环境不同,催化剂通常从空阻小的一侧被吸附,顺型加氢。
4 其他反应
(1)Perkin反应
芳醛与含α-H的脂肪族酸酐,在相应的羧酸盐存在下共热,发生缩合生成α,β-不饱和酸,该反应称为珀金(Perkin)反应。
(2)Mannich反应
含有α-H 的醛(酮),与甲醛和氨(或1°胺、2°胺)的盐酸盐之间发生的缩合反应,称为曼尼希(Mannich)反应。
该反应的净结果是二甲氨甲基取代了α-H,故又称为氨甲基化反应,产物为β-氨基酮。
Mannich反应通常是在酸性溶液中进行,除醛、酮外,其它含α-H的化合物如酯、腈等也可发生该反应。
后续更新......